Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (llamadas reactivos o refractantes) y las sustancias que se originan (llamadas productos). La ecuación química ayuda a ver y visualizar los reactivos que son los que tendrán una reacción química y el producto, que es la sustancia que se obtiene de este proceso. Además se puede ubicar los símbolos químicos de cada uno de los elementos o compuestos que estén dentro de la ecuación y poder balancearlos con mayor facilidad.











A + B → C + D + calor
H + H = H2
ΔH = -104 kcal/mol







Ecuación química
Es la representación gráfica o simbólica de una reacción química que muestra las sustancias, elementos o compuestos que reaccionan (llamados reactantes o reactivos) y los productos que se obtienen. La ecuación química también nos muestra la cantidad de sustancias o elementos que intervienen en la reacción, en sí es la manera de representarlas.
Reacción química
Es también llamado cambio químico y se define como todo proceso químico en el cual una o más sustancias sufren transformaciones químicas. Las sustancias llamas reactantes se combina para formar productos.
En la reacción química intervienen elementos y compuestos. Un ejemplo de ello es el Cloruro de Sodio (NaCl) o comúnmente conocido como "sal de mesa" o "sal común".
La diferencia entre una ecuación y una reacción química es simple: En la ecuación es la representación simbólica lo cual utilizamos letras, símbolos y números para representarla, mientras que en la reacción química es la forma "practica" de la misma (Cuando se lleva a cabo).
Balanceo de una ecuación química
Balancear una ecuación significa que debe de existir una equivalencia entre el número de los reactivos y el número de los productos en una ecuación. Lo cual, existen distintos métodos, como los que veremos a continuación
Para que un balanceo sea correcto: "La suma de la masa de las sustancias reaccionantes debe ser igual a la suma de las
Masas de los productos"
Veremos 3 tipos de balanceo de ecuaciones químicas: Balanceo por TANTEO, OXIDO-REDUCCIÓN (REDOX) Y MATEMATICO O ALGEBRAICO:
BALANCEO POR TANTEO
Para balancear por este o todos los demás métodos es necesario conocer la Ley de la conservación de la materia, propuesta por Lavoisier en 1774. Dice lo siguiente
"En una reacción química, la masa de los reactantes es igual a la masa de los reactivos" por lo tanto "La materia no se crea ni se destruye, solo se transforma"
Como todo lleva un orden a seguir, éste método resulta más fácil si ordenamos a los elementos de la siguiente manera:
Balancear primero
Metales y/o no metales
Oxígenos
Hidrógenos
De esta manera, nos resulta más fácil, ya que el mayor conflicto que se genera durante el balanceo es causado principalmente por los oxígenos e hidrógenos.
Balancear por el método de tanteo consiste en colocar números grandes denominados "Coeficientes" a la derecha del compuesto o elemento del que se trate. De manera que Tanteando, logremos una equivalencia o igualdad entre los reactivos y los productos.
Ejemplo:
Balancear la siguiente ecuación química:

donde:
- A, B, C, D, representan los símbolos químicos o la fórmula molecular de los átomos o moléculas que reaccionan (lado izquierdo) y los que se producen (lado derecho).
- a, b, c, d, representan los coeficientes estequiométricos , que deben ser ajustados de manera que sean reflejo de la ley de conservación de la masa.
La interpretación física de los coeficientes estequiométricos, si estos son números enteros y positivos, puede ser en átomos o moles. Así, se diría de la ecuación de geometría estequiometrica se subdivide en la siguiente:
- Cuando "a" átomos (o moléculas) de A reaccionan con "b" átomos (o moléculas) de B producen "c" átomos (o moléculas) de C, y "d" átomos (o moléculas) de D.
- Cuando "a" moles de átomos (o moléculas) de A reaccionan con "b" moles de átomos (o moléculas) de B producen "c" moles de átomos (o moléculas) de C, y "d" moles de átomos (o moléculas) de D.
Por ejemplo el hidrógeno (H2) puede reaccionar con oxígeno (O2) para dar agua (H2O). La ecuación química para esta reacción se escribe:
1. Conceptos claves del tema
Concepto de ecuación química
Una reacción química es cualquier proceso en el que, por lo menos, los átomos, las moléculas o los iones de una sustancia se transforman en átomos, moléculas o iones de otra sustancia química distinta. Las reacciones químicas se escriben de forma simplificada mediante ecuaciones químicas.
En las reacciones químicas se cumple la ley de conservación de la masa, teniendo lugar una re ordenación de los átomos, pero no su creación ni su destrucción. El re ordenamiento de los átomos en la molécula da lugar a una sustancia distinta.
Las sustancias que se transforman o modifican en una reacción se llaman reaccionantes, reactivos o reactantes. Las sustancias nuevas que se originan en una reacción química se llaman productos.
Una de las reacciones químicas más usuales es la combustión del gas natural (mezcla de sustancias donde el metano, CH4, es el compuesto principal), cuya ecuación es:

La ecuación está «igualada», esto es, en cada miembro de la reacción hay el mismo número de átomos de cada elemento.












Las transformaciones que ocurren en una reacción quimica se rigen por la Ley de la conservación de la masa: Los átomos no se crean ni se destruyen durante una reacción química.
Entonces, el mismo conjunto de átomos está presente antes, durante y después de la reacción. Los cambios que ocurren en una reacción química simplemente consisten en una reordenación de los átomos.
Por lo tanto una ecuación química ha de tener el mismo número de átomos de cada elemento a ambos lados de la flecha. Se dice entonces que la ecuación está balanceada.
| 2H2 | + | O2 |  | 2H2O |
| Reactivos | Productos | |||
| 4H | y | 2O | = | 4H + 2O |
Pasos que son necesarios para escribir una reacción ajustada:
1) Se determina cuales son los reactivos y los productos.
2) Se escribe una ecuación no ajustada usando las fórmulas de los reactivos y de los productos.
3) Se ajusta la reacción determinando los coeficientes que nos dan números iguales de cada tipo de átomo en cada lado de la flecha de reacción, generalmente números enteros.
Ejemplo 1:
Consideremos la reacción de combustión del metano gaseoso (CH4) en aire.
Paso 1:
Sabemos que en esta reacción se consume (O2) y produce agua (H2O) y dióxido de carbono (CO2).
Luego:
los reactivos son CH4 y O2, y
los productos son H2O y CO2
Paso 2:
la ecuación química sin ajustar será:

Paso 3:
Ahora contamos los átomos de cada reactivo y de cada producto y los sumamos:

Entonces,
una molécula de metano reacciona con dos moléculas de oxígeno para producir dos moléculas agua y una molécula de dióxido de carbono.
una molécula de metano reacciona con dos moléculas de oxígeno para producir dos moléculas agua y una molécula de dióxido de carbono.
Ejemplo 2:


Ecuación balanceada

Ejemplo 3:

Ajustar primero la molécula mayor

Ahora ajustamos el O.

Multiplicamos por dos:

Ejemplo 4:
Descomposición de la urea:

Para balancear únicamente duplicamos NH3 y así:

Ejemplo 5:


Ajuste de las ecuaciones químicas
Para ajustar una ecuación química hay que seguir el orden siguiente:
- Primero se ajustan los átomos de los metales, teniendo prioridad los más pesados.
- A continuación se ajustan los no metales, teniendo también prioridad los más pesados.
- Se revisa, si es necesario, el ajuste de los metales.
- Se comprueba el ajuste contando los átomos de hidrógeno y de oxígeno que intervienen.
Por ejemplo, para ajustar la reacción:
BaCl2 + Na2SO4 ® NaCl
2. CARACTERÍSTICAS Y ECUACIONES QUIMICAS
Una reacción química, cambio químico o fenómeno químico, es todo proceso termodinámico en el cual una o más sustancias (llamadas reactantes), por efecto de un factor energético, se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
A la representación simbólica de las reacciones se les llama ecuaciones químicas.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.
Hay problemas resueltos en el FORO DE QUÍMICA
| ||
| 1 | H2+ O2 <--> H20 | solución |
| 2 | N2 + H2 <--> NH3 | solución |
| 3 | H2O + Na <--> Na(OH) + H2 | solución |
| 4 | KClO3 <--> KCl + O2 | solución |
| 5 | BaO2 + HCl <--> BaCl2 + H2O2 | solución |
| 6 | H2SO4 + NaCl <--> Na2SO4 + HCl | solución |
| 7 | FeS2 <--> Fe3S4 + S2 | solución |
| 8 | H2SO4 + C <--> H20 + SO2 + CO2 | solución |
| 9 | SO2 + O2 <--> SO3 | solución |
| 10 | NaCl <--> Na + Cl2 | solución |
| 11 | HCl + MnO2 <--> MnCl2 + H20 + Cl2 | solución |
| 12 | K2CO3 + C <--> CO + K | solución |
| 13 | Ag2SO4 + NaCl <--> Na2SO4 + AgCl | solución |
| 14 | NaNO3 + KCl <--> NaCl + KNO3 | solución |
| 15 | Fe2O3 + CO <--> CO2 + Fe | solución |
| 16 | Na2CO3 + H2O + CO2 <--> NaHCO3 | solución |
| 17 | FeS2 + O2 <--> Fe2O3 + SO2 | solución |
| 18 | Cr2O3 + Al <--> Al2O3 + Cr | solución |
| 19 | Ag + HNO3 <--> NO + H2O + AgNO3 | solución |
| 20 | CuFeS2 + O2 <--> SO2 + CuO + FeO | solución |
3. Clases de reacciones químicas: (características, formula general, ejemplos e
importancia)
CARACTERISTICAS
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.
La importancia de dichas reacciones es notoria en muchos aspectos de la vida diaria en fenómenos tales como explosiones; procesos vitales tales como alimentación, respiración etc. Todas las sustancias que a diario utilizamos son o fueron producto de reacciones químicas.
FORMULA GENERAL
Proceso en el que cambia la naturaleza de una o varias sustancias (reactivos), transformándose en otras nuevas (productos). Esto supone un re ordenamiento de los átomos, mediante la ruptura de unos enlaces y la formación de otros nuevos.
Una reacción química se representa mediante una ecuación química: En el primer miembro aparecen las fórmulas de las sustancias que reaccionan (reactivos), y en el segundo miembro aparecen las fórmulas de las sustancias que se forman (productos), separados por una flecha, si la reacción es irreversible o por dos (una para cada sentido), si la reacción es reversible. Además de las fórmulas de las sustancias, deben aparecer los denominados coeficientes estequiométricos, los cuales nos indican la proporción (moles) de las sustancias que intervienen en la reacción (ajuste). En algunos casos es necesario adjuntar el estado de agregación de la materia entre paréntesis (sólido, líquido o gas). La fórmula general será del tipo:
xA+yB zC+tD
donde A y B son los reactivos, C y D los productos formados tras la reacción, y `x, y, z, t' son los coeficientes estequiométricos.
EJEMPLOS:
a) 2Na + Cl2 2NaCl (irreversible)
b) H2CO3 CO2 + H2O (reversible)
c) 2H2(g) + O2(g) 2H2O(l) (estados de agregación)
Los números de color azul son los coeficientes estequiométricos.
Fórmulas
a. Conceptos de símbolo y fórmula.
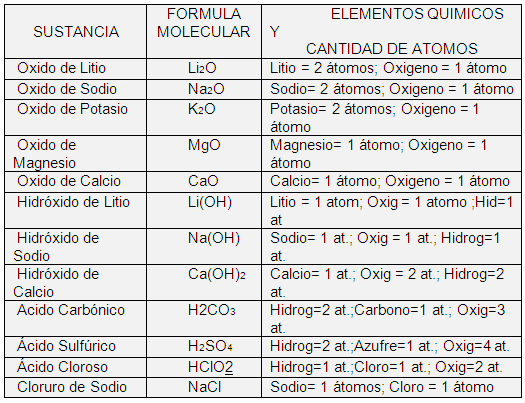
Símbolo químico. Es la representación escrita y abreviada del nombre de un elemento químico.
Todos los elementos químicos tienen su propio nombre, el cual se ha - abreviado mediante un símbolo que está compuesto o formado por una, dos y hasta tres letras; por ejemplo, hay un elemento químico llamado Calcio cuyo nombre se ha abreviado a dos letras Ca, que forman así el símbolo del Calcio; así pues, se establece simplemente que los símbolos químicos representan a los elementos o sustancias simples.
Formula química. Es la representación escrita y abreviada de una sustancia.
Las formulas son como una clave química o una notación (representación por medio de signos convencionales). Cada tipo de sustancia existente tiene su propia formula, o sea, una formula sirve para identificar a una sustancia en particular.
b. Tipos de fórmulas.
Existen tres tipos fundamentales o principales de fórmulas: molecular, desarrollada o estructural y semi-desarrollada.

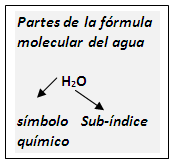
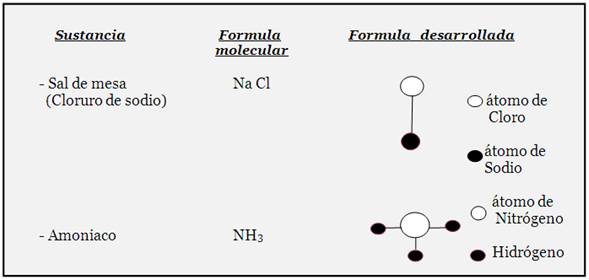
Formula molecular: es la representación gráfica y real de una sustancia. Es conocida también como fórmula condensada. Esta fórmula nos indica que clase de elementos químicos componen a la sustancia que representa (aspecto cualitativo), así como la cantidad de átomos de cada elemento (aspecto cuantitativo); la misma está compuesta de Símbolos químicos y números. Los números son enteros y pequeños, llamados subíndices, e indican la cantidad de átomos del elemento químico que lo conlleva; se ubican en la parte inferior derecha de cada símbolo, y cuando no aparece ningún número como sub-índice entonces se supone que es uno (1), el cual nunca se escribe. Observe las situaciones siguientes:
H2 es la fórmula de dos átomos de Hidrogeno unidos (molécula).
O es el símbolo químico de un átomo de Oxigeno; no es una formula.
O2 es la fórmula molecular del Oxigeno (sustancia simple).
H2O es la fórmula de una molécula de agua (sustancia compuesta).
Más ejemplos de formula molecular.

Observe que todas las formulas anteriores tienen coeficiente uno (1), por lo que cada una de ellas representa tan solo a una molécula de su respectiva sustancia. De aquí proviene su nombre de formula molecular.
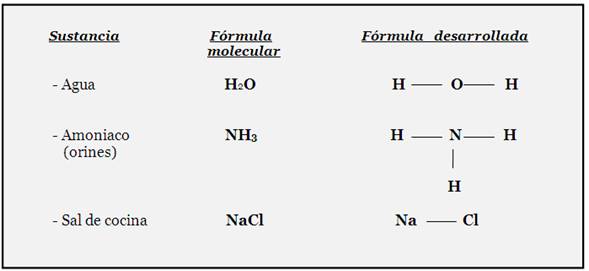
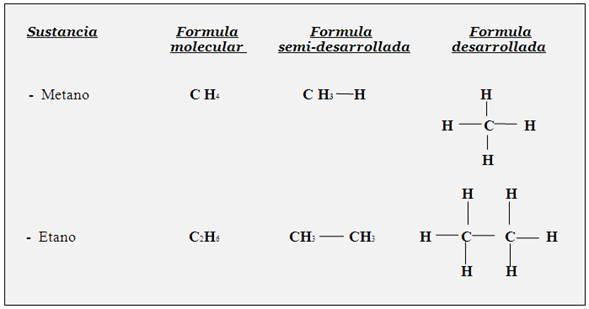
Formula desarrollada: es la representación espacial de una molécula de cualquier sustancia, mediante todos sus símbolos y enlaces químicos(guiones).
También se conoce como fórmula estructural. Los símbolos químicos se unen mediante guiones o líneas de Lang- muir, las que representan a los enlaces químicos, formándose así toda una estructura.

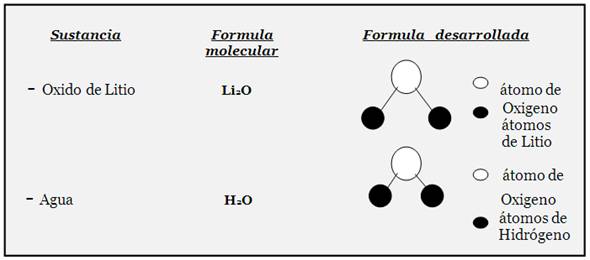
Otra manera de representar a la formula desarrollada o estructural es la siguiente:

Más ejemplos de fórmulas molecular y desarrollada:

La fórmula desarrollada proporciona más información sobre una sustancia en particular, pues muestra la composición y estructura de una molécula, es decir, esta fórmula muestra un bosquejo de los tipos y cantidades de los á- tomos que forman a una sustancia química, así como también la manera en que se unen o enlazan tales átomos.
Se sabe que una molécula es la estructura más pequeña y representativa de una sustancia; y esta fórmula explica gráficamente esto: la clase y cantidad de átomos (composición) de una molécula, y la posición (estructura) de es -
tos. Las líneas de color negro que unen a los átomos, en la formula desarrollada, representan a los enlaces quími -
cos o uniones entre los átomos de una molécula (compartición, pérdida y ganancia de electrones entre átomos).
Formula semi- desarrollada: es la representación semi-condensada de una sustancia.
También conocida como semi-condensada. Esta fórmula es muy utilizada en Química orgánica; sin embargo, la misma no reviste interés para nuestro estudio, por lo que no se detallara.
Ejemplos de formula semi-desarrollada.

Ecuaciones químicas
Antes de explicar el concepto de ecuación química debemos de estudiar lo de las reacciones químicas. Cuando dos o más sustancias se combinan entre si entonces reaccionan y origina una o más sustancias nue nuevas; es decir, las reacciones químicas significan cambios químicos o intercambios de átomos entre las sustancias que se combinan. Esto es que, uno o más átomos de una de las sustancias combinadas se separan y luego se unen a la otra sustancia, e igual puede suceder en la otra sustancia, produciéndose así un reacomodo de átomos y, por lo tanto, nuevas sustancias.
En la combinación de dos o más sustancias puras no hay re-acomodo de átomos, sino que estos simplemente se u - nen o enlazan. Lo que sucede dentro de las reacciones químicas no puede ser apreciado por el sentido de la vista, y ni siquiera mediante el mejor de los microscopios; sin embargo, el hombreha razonado esta situación y ha sabido ex plicarla por escrito mediante las ecuaciones químicas.
a. Concepto de ecuación química. Es la representación escrita de una reacción química, mediante símbolos.
Usted ya comprende lo que es una reacción química; ahora bien, mediante una ecuación química se explica en qué tipo de sustancias se convierten aquellas sustancias que se combinan; y esta explicación se hace abreviadamente y por escrito, mediante símbolos y números.
A veces los elementos químicos que forman a una sustancia compuesta se separan químicamente con solo aplicar les calor, y así se originan nuevas sustancias, lo cual es también una reacción química y, por lo tanto, hay una ecua - ción química para ello. En resumen, en una ecuación química se muestran las sustancias y sus respectivas cantidades que se combinan (llamadas reactivos), así como también las sustancias que se producen (nuevas) o que resultan de tal combinación (productos).
b. Partes de una ecuación. Una ecuación está formada por varias partes, las cuales se pueden agrupar de dos maneras: reactivos y productos, y símbolos y números.
Reactivos y productos. Las sustancias que se combinan se llaman reactivos, y se localizan a la izquierda de la ecua- ción; y a las sustancias que resultan de tal combinación se les nombra productos (sustancias nuevas), localizadas a la derecha de la ecuación. Por ejemplo, cuando el Hidrogeno se combina con Oxigeno (reactivos) reaccionan y originan una nueva sustancia llamada agua (producto); esta reacción química se puede representar mediante una ecuación denominada ecuación del agua, así:

EJEMPLOS
Reacción Ácido Base:
- 2HCl + Zn –> ZnCl2 + H2
- NaOH + HCL –> NaCl + H2O
- Fe(OH)2 + H2SO4 –> FeSO4 + H2O
- CuO + 2HCL –> CuCl2 + H2O
Reacción de Combustión:
- O2 + C –> CO2
- 2SH2 + 3O2 –> 2SO2 + 2H2O
- Cu + O2 –> CuO2
Reacción de Oxidación:
- 2Fe + O2 = 2FeO
- 4Al + 3O2 = 2Al203
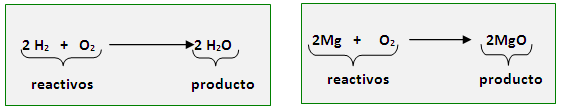
- 2Mg + O2 –> 2MgO
El producto de una reacción química es una substancia de naturaleza totalmente diferente a la de los reactivos.
procesos químicos ocurridos
Una reacción de síntesis' o reacción de combinación es un proceso elemental en el que dos sustancias químicas reaccionan para generar un solo producto. Elementos o compuestos sencillos que se unen para formar un compuesto más complejo. La siguiente es la forma general que presentan este tipo de reacciones:
Donde A y B representan cualquier sustancia química.
Algunas reacciones de síntesis se dan al combinar un óxido básico con agua, para formar un hidróxido, o al combinar el óxido de un no metal con agua para producir un oxi-ácido.
Ejemplos:
- Na2O(s) + H2O(l) → 2Na(OH)(ac)
- SO3(g) + H2O(l) → H2SO4(ac)
Otras reacciones de síntesis se dan al combinar un no metal con hidrógeno, para obtener un hidrácido.
Ejemplo:
- Cl2(g)+ H2(g) → 2HCl(g)
La oxidación de un metal, también es una reacción de síntesis o de combinación.
Ejemplo:
- 4Na(s) + O2(g) → 2Na2O(s) kk
Los productos que se obtienen de ciertos reactivos dependerán de las condiciones persistentes en la reacción química en cuestión, aunque, si bien es una realidad esto que se sostiene que los productos varían de acuerdo a las condiciones, determinadas cantidades no sufren ningún tipo de modificación y por tanto permanecen constantes en cualquier reacción química.
La física reconoce dos grandes modelos de reacciones químicas, las reacciones ácido-base, que no presentan modificaciones en los estados de oxidación y las reacciones redox, que por el contrario sí presentan modificaciones en los estados de oxidación.
En tanto, dependiendo del tipo de productos que resulta de la reacción a las reacciones químicas se las clasifica de la siguiente manera: reacción de síntesis (elementos o compuestos simples se unen para conformar un compuesto más complejo), reacción de descomposición (el compuesto se fragmenta en elementos o compuestos más simples; un solo reactivo se convierte en productos), reacción de desplazamiento o simple sustitución (un elemento reemplaza a otro en un compuesto) y reacción de doble desplazamiento o doble sustitución (los iones de un compuesto modifican lugares con los propios de otro compuesto para conformar dos sustancias diferentes).
- DESPLAZAMIENTO DE REACCIONES QUIMICAS
- En general se presenta cuando un elemento químico mas activo o mas reactivo desplaza a otro elemento menos reactivo que se encuentra formando parte de un compuesto; el elemento que a sido desplazado queda en forma libre.En el caso de los metales, los mas activos son los metales alcalinos y metales alcalinos térreos.En el caso de los no metales, los mas reactivos son algunos halogenos : Fl2 , Cl2 , Br2 ; además del oxígeno y el fósforo.
- También llamada de doble descomposición o metátesis, es una reacción entre dos compuestos que generalmente están cada uno en solución acuosa. Consiste en que dos elementos que se encuentran en compuestos diferentes intercambian posiciones, formando dos nuevos compuestos. Estas reacciones quimicas no presentan cambios en el numero de oxidación o carga relativa de los elementos, por lo cual también se le denominan reacciones NO – REDOX.
Esquema General:
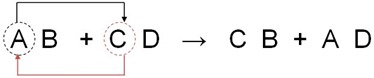 Ejemplos:En reacciones de precipitación se producen sustancias parcialmente solubles o insolubles, los cuales van al fondo del recipiente donde se realiza la reaccion quimica. Los precipitados por lo general presentan colores típicos, razón por la cual son usados en quimica analítica para reconocimiento de elementos y compuestos.
Ejemplos:En reacciones de precipitación se producen sustancias parcialmente solubles o insolubles, los cuales van al fondo del recipiente donde se realiza la reaccion quimica. Los precipitados por lo general presentan colores típicos, razón por la cual son usados en quimica analítica para reconocimiento de elementos y compuestos.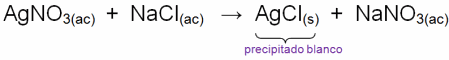
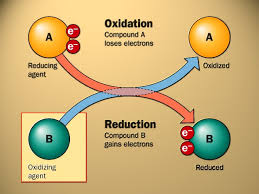
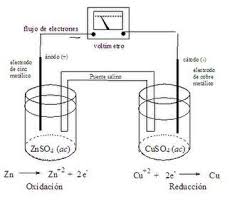
- Una reacción REDOX, implica transferencia eléctrica, es decir, que para una reacciónde este tipo suceda necesariamente una especie química debe ceder electrones y otra debe captar o aceptar esos electrones. La oxidación es el proceso en que un átomo, ión o molécula pierde uno o máselectrones; la reducción implica ganancia de uno o más electrones por parte de un átomo, in o molécula. Un agente reductor es una sustancia que pierde uno o más electrones y en este proceso se oxida;un agente oxidante gana uno o más electrones y con ello se reduce. Dicho de otra forma, un reductor es un donador de electrones y un oxidante es un receptor de electrones
La gran mayoría de reacciones que son de interés, en química son reacciones de reducción y oxidación, como ejemplos tenemos: la combustión de los hidrocarburos, la acción de los agentes blanqueadores de uso domestico, la obtención de los metales a partir de sus minerales, el proceso de respiración, proceso de digestión, reacción que ocurre en la pila seca y baterías, etc..
- 1. REACCIONES DE DESPLAZAMIENTO O SUSTITUCIÓN
- 2. Esuna reacción en la cual los átomos de un elemento sustituyen o reemplazan los átomos de otro en un compuesto. A + BX AX + B
- 3. METAL + AGUA → HIDRÓXIDO + HIDRÓGENO El litio (un metal) desplaza 1 átomo de hidrógeno de la molécula de agua. 2 Li + 2 H2O 2 LiOH + H2
- 4. METAL + ACIDO → SAL + HIDRÓGENO El litio (un metal) desplaza 1 átomo de hidrógeno de la molécula de ácido. 2 Li + 2 HCl 2 LiCl + H2
- 5. METAL1 + SAL → SAL + METAL2 Los átomos de cobre (otro metal) sustituyen a los átomos de plata ( otro metal). Cu + 2 AgNO3 2 Ag + Cu(NO3)2
- 6. HALÓGENO1 + SAL → SAL + HALÓGENO2 Un no metal (el flúor) reemplaza a otro no metal (el bromo). F2 + 2 NaBr 2 NaF + Br2
- 7. La capacidad de una sustancia de reaccionar con otra se denomina REACTIVIDAD. Los elementos más reactivos pueden desplazar a los elementos menos reactivos, generándose una reacción, sin embargo, un elemento menos activo no puede reemplazar a otro más activo, por lo cual no se genera una reacción química.
- 8. Por ejemplo: Br2 + 2NaF NO REACCIONA Fe + CuSO4 FeSO4 + Cu Mg + AlCl2 MgCl2 + Al Br2 + MgCl2 NO REACCIONA
REACCIONES REVERSIBLES
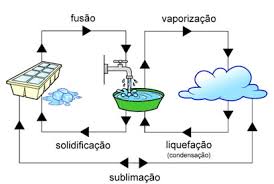
En la naturaleza hay muchos procesos reversibles, es decir, procesos que se dan en dos sentidos. Así, son ejemplos de procesos físicos reversibles la sublimación de un sólido en un recipiente cerrado, la evaporación de un líquido en un recipiente cerrado...
Naftalina sólida  Naftalina gaseosa
Naftalina gaseosa
Hay procesos químicos reversibles y, al final de la reacción, lo que obtenemos es una mezcla de reactivos y de productos. A esta situación final la llamamos equilibrio químico y, aunque las concentraciones de las diferentes sustancias permanecen constantes, éste no es estático ya que tanto los productos como los reactivos continúan reaccionando.
N2O4(g)  2 NO2(g)
2 NO2(g)
REACCIONES IREVERSIBLES
La reacción ocurre hasta que se agota al menos uno de los reactivos, que se llama «reactivo limitante».1
Puede simbolizarse con la siguiente ecuación química:2
Esta sería la ecuación de dos substancias que reaccionan entre sí para dar dos productos, a, b y c, d son los coeficientes estequiométricos, el número de moles relativos de los reactivos A, B y de los productos C, D respectivamente. La flecha indica un único sentido para la reacción.3
Las reacciones de combustión son un ejemplo de reacciones irreversibles, en las que K puede tomar valores enormes.
Por ejemplo el petróleo –que podemos simbolizar con  , o la madera, arden en presencia de oxígeno (O2) para transformarse principalmente en dióxido de carbono (CO2) y agua (H2 O), liberando energía térmica (reacción exotérmica). Estos productos necesitarán de procesos biológicos de fotosíntesis para volver a transformarse en substancias orgánicas, pero no se transformarán de forma espontánea en los reactivos originales.4
, o la madera, arden en presencia de oxígeno (O2) para transformarse principalmente en dióxido de carbono (CO2) y agua (H2 O), liberando energía térmica (reacción exotérmica). Estos productos necesitarán de procesos biológicos de fotosíntesis para volver a transformarse en substancias orgánicas, pero no se transformarán de forma espontánea en los reactivos originales.4
 , o la madera, arden en presencia de oxígeno (O2) para transformarse principalmente en dióxido de carbono (CO2) y agua (H2 O), liberando energía térmica (reacción exotérmica). Estos productos necesitarán de procesos biológicos de fotosíntesis para volver a transformarse en substancias orgánicas, pero no se transformarán de forma espontánea en los reactivos originales.4
, o la madera, arden en presencia de oxígeno (O2) para transformarse principalmente en dióxido de carbono (CO2) y agua (H2 O), liberando energía térmica (reacción exotérmica). Estos productos necesitarán de procesos biológicos de fotosíntesis para volver a transformarse en substancias orgánicas, pero no se transformarán de forma espontánea en los reactivos originales.4
Las reacciones de los hidrocarburos (por ejemplo el petróleo y sus derivados) pueden representarse de esta manera:
Otra reacción química irreversible es aquella en la que uno de los productos, al menos, escapa del sistema reaccionante, por ejemplo, como lo hace el dióxido de carbono (volátil) en la reacción siguiente:
Cuando la constante de equilibrio de una reacción reversible es muy grande, a los fines prácticos puede considerarse que es irreversible y que ocurre en una sola dirección. Aún cuando en el equilibrio exista una reacción inversa, ésta será insignificante.
Esto último puede ser considerado un caso extremo, "casos especiales" de reacciones reversibles, aquellas en la que la constante de equilibrio es de un valor grande. Cuando el cambio de la energía libre de Gibas es grande, también lo será la constante de equilibrio, y las concentraciones de los reactivos en el equilibrio serán muy pequeñas. Tal reacción es considerada en la práctica una reacción irreversible, aún cuando en realidad pequeñas cantidades de los reactivos estarán presentes en el sistema de reacción en el equilibrio.
Se llama reacción reversible a la reacción química en la cual los productos de la reacción vuelven a combinarse para generar los reactivos.
Este tipo de reacción se representa con una doble flecha, donde la flecha indica el sentido de la reacción.
Esta ecuación representa una reacción directa (hacia la derecha) que ocurre simultáneamente con una reacción inversa (hacia la izquierda):
aA + bB = cC + dD
Donde a, b y c, d representan el número de moles relativos de los reactivos A, B y de los productos C, D respectivamente y se los llama coeficientes estequiométricos.
Se llama reacción reversible a la reacción química en la cual los productos de la reacción vuelven a combinarse para generar los reactivos.
Este tipo de reacción se representa con una doble flecha, donde la flecha indica el sentido de la reacción.
Esta ecuación representa una reacción directa (hacia la derecha) que ocurre simultáneamente con una reacción inversa (hacia la izquierda):
aA + bB = cC + dD
Donde a, b y c, d representan el número de moles relativos de los reactivos A, B y de los productos C, D respectivamente y se los llama coeficientes estequiométricos.
CAMBIOS ENÉRGICOS PRODUCIDOS
EXOTERMICAS
Se denomina reacción exotérmica a cualquier reacción química que desprenda energía, ya sea como luz o calor,1 o lo que es lo mismo: con una variación negativa de la entalpía; es decir: -ΔH. El prefijo exo significa «hacia fuera». Por lo tanto se entiende que las reacciones exotérmicas liberan energía. Considerando que A, B, C y D representen sustancias genéricas, el esquema general de una reacción exotérmica se puede escribir de la siguiente manera:
Ocurre principalmente en las reacciones de oxidación. Cuando éstas son intensas pueden generar fuego. Si dos átomos de hidrógeno reaccionan entre sí e integran una molécula, el proceso es exotérmico.
Son cambios exotérmicos las transiciones de gas a líquido (condensación) y de líquido a sólido (solidificación).
Un ejemplo de reacción exotérmica es la combustión.
La reacción contraria, que consume energía, se denomina endotérmica.
Cambios energéticos en las reacciones químicas
Uno de los objetivos de estudio de la química es la trasformación de la materia debida a su interacción con la energía. La energía implicada es unareacción química por lo general se observa en forma de calor y expresa como el calor de reacción.
Ejemplo:
1cal = 4.184 J
1kcal = 4.184 kJ
Entalpía de reacción
Un cambio en la entalpia es elcalor absorbido o desprendido de la reacción.
⍙H = H (productos) –H (reactivos)
El cambio de entalpia se escribe del lado derecho de la ecuación química.
H2 (g) + 1/202(g) H2 O (1) ⍙H = -286 kJ
Elvalor de ⍙H se puede determinar experimentalmente midiendo el flujo de calor que acompaña a una reacción a presión constante.
La medición de flujo de calor se llama calorimetría y el aparato con elcual se mide se llama calorímetro.
Velocidad de reacción
Es el cambio en la concentración de un reactivo o producto por unidad de tiempo. La parte de la química encargada de estudiar la velocidad delas reacciones y delos factores que la modifican se llaman cinética química.
La velocidad de una reacción química , permite al químico diseñar un producto para obtener un alto rendimiento deproducto, la velocidad de reacción también es importante e el procesamiento de alimentos.
Teoría de colisiones
Esta permite explicar la velocidad de una reacción química.
La frecuencia de colisióndepende de la concentración de los reactivos y de su temperatura.
Un aumento en la temperatura afecta también la frecuencia de colisiones debido a que las partículas se mueven con mayor rapidez.
Laenergía de activación para una reacción depende del tipo específico de las sustancias que participan.
La energía de activación de activación se puede suministrar en forma de calor o de luz.
Cambios energéticos en las reacciones químicas
Uno de los objetivos de estudio de la química es la trasformación de la materia debida a su interacción con la energía. La energía implicada es unareacción química por lo general se observa en forma de calor y expresa como el calor de reacción.
Ejemplo:
1cal = 4.184 J
1kcal = 4.184 kJ
Entalpía de reacción
Un cambio en la entalpia es elcalor absorbido o desprendido de la reacción.
⍙H = H (productos) –H (reactivos)
El cambio de entalpia se escribe del lado derecho de la ecuación química.
H2 (g) + 1/202(g) H2 O (1) ⍙H = -286 kJ
Elvalor de ⍙H se puede determinar experimentalmente midiendo el flujo de calor que acompaña a una reacción a presión constante.
La medición de flujo de calor se llama calorimetría y el aparato con elcual se mide se llama calorímetro.
Velocidad de reacción
Es el cambio en la concentración de un reactivo o producto por unidad de tiempo. La parte de la química encargada de estudiar la velocidad delas reacciones y delos factores que la modifican se llaman cinética química.
La velocidad de una reacción química , permite al químico diseñar un producto para obtener un alto rendimiento deproducto, la velocidad de reacción también es importante e el procesamiento de alimentos.
Teoría de colisiones
Esta permite explicar la velocidad de una reacción química.
La frecuencia de colisióndepende de la concentración de los reactivos y de su temperatura.
Un aumento en la temperatura afecta también la frecuencia de colisiones debido a que las partículas se mueven con mayor rapidez.
Laenergía de activación para una reacción depende del tipo específico de las sustancias que participan.
La energía de activación de activación se puede suministrar en forma de calor o de luz.
ENDOTERMICAS
Se denomina reacción endotérmica a cualquier reacción química que absorbe energía.
Si hablamos de entalpía (H), una reacción endotérmica es aquella que tiene un incremento de entalpía o ΔH positivo. Es decir, la energía que poseen los productos es mayor a la de los reactivos.
Las reacciones endotérmicas y especialmente las relacionadas con el amoníaco impulsaron una próspera industria de generación de hielo a principios del siglo XIX. Actualmente el frío industrial se genera con electricidad en máquinas frigoríficas.
Ejemplo de reacción endotérmica
Un ejemplo de reacción endotérmica es la producción del ozono (O3). Esta reacción ocurre en las capas altas de la atmósfera, gracias a la radiación ultravioleta proporcionada por la energía del Sol. También se produce esta reacción en las tormentas, en las proximidades de las descargas eléctricas.
3O2 + ENERGÍA da lugar a 2O3 ; ΔH > 0
Una reaccion endotermica es aquella reaccion que toma energia del medio para poder ocurrir, en particular toma energia termica del medio para poder ocurrir, estas reacciones se ven favorecidas al aplicarles calor, de otra manera serian muy lentas o no ocurririan
Un ejemplo de reaccion endotermica es la produccion de sulfuro de hierro a partir de hierro y azufre:
Fe (s) + S (s) + calor ---> FeS (s)
otro ejemplo es la produccion de hierro metalico a partir de oxido de hierro y de carbono tipo grafito, esta reaccion es usada en la industria siderurgica para la produccion de hierro:
FeO (s) + C (graf.) ---> Fe (s) + CO (g)
Una reaccion endotermica es aquella reaccion que toma energia del medio para poder ocurrir, en particular toma energia termica del medio para poder ocurrir, estas reacciones se ven favorecidas al aplicarles calor, de otra manera serian muy lentas o no ocurririan
Un ejemplo de reaccion endotermica es la produccion de sulfuro de hierro a partir de hierro y azufre:
Fe (s) + S (s) + calor ---> FeS (s)
otro ejemplo es la produccion de hierro metalico a partir de oxido de hierro y de carbono tipo grafito, esta reaccion es usada en la industria siderurgica para la produccion de hierro:
FeO (s) + C (graf.) ---> Fe (s) + CO (g)
4. Métodos para balancear ecuaciónes químicas: procedimientio y ejemplos
BALANCEO DE ECUACIONES POR TANTEO
Una reacción química es la manifestación de un cambio en la materia y la isla de un fenómeno químico. A su expresión gráfica se le da el nombre de ecuación química, en la cual, se expresan en la primera parte los reactivos y en la segunda los productos de la reacción.
En este tema aprenderás a determinar los coeficientes para balancear una ecuación.
Observa la siguiente ecuación: 2 C4H10(g) + 13 O2(g) --> 8 CO2(g) + 10 H2O(g) + 872 kJ Los números 2, 13, 8 y 10 se llaman coeficientes l¿ De dónde salieron? ¿Para qué sirven?
Balancear significa buscar un “punto de equilibrio” entre dos parte; precisamente el balanceo de ecuaciones consiste en que busques que “coeficientes” debes de anotar para que la “cantidad” de cada uno de los elementos que está en los reactantes se iguale con la de los productos.
El hierro Fe, al contacto con el aire, lentamente se va oxidando, hasta transformarse en un polvo café- rojizo; éste es un ejemplo de reacción química.
Para escribir la ecuación de esta reacción; primero anotas las sustancias que están reaccionado, que son el fierro (Fe) y el oxígeno (O2) , después una flecha que indica la transformación y enseguida los productos. La ecuación queda de la siguiente manera: Fe + O2 ______ Fe2O3
Pero esta ecuación no esta completa, le faltan los “coeficientes”que indican que la ecuación está balanceada. ¿Cómo los vas a encontrar?, ¿Cuáles son esos números?
Para determinar los coeficientes se puede hacer por dos métodos:
A) Por tanteo
B) Por oxido-reducción.
A) Balanceo por tanteo
Pasos:
1.Contar la “cantidad” que hay de cada elemento.
Para esto observa si los elementos tienen subíndice, este número indica la cantidad, si no tienen número significa que es uno. Ejemplo en los reactantes el Fe no tiene subíndice, entonces hay uno , el oxigeno tiene subíndice 2, significa que son dos, en los productos el Fe tiene un subíndice 2, por lo tanto hay dos y el oxígeno tiene un tres, entonces hay 3. Escribes esta información, debajo de la ecuación.
Fe + O2 Fe2O3
Reactantes ProductosFe 1 2
O 2 3
2. La ecuación no esta balanceado porque las cantidades de Fierro y Oxígeno son diferentes en los reactantes y en los productos, el siguiente paso es anotar un coeficiente 2, 3, 4, etc, empieza con el dos, si no da, intenta con el que sigue y así sucesivamente, volver a contar la cantidad de cada elemento en cada intento, hasta que la ecuación quede balanceada.
Veamos que sucede si anotamos como coeficiente un 2 al Fe (Recuerda el lugar donde se escriben los coeficientes) 2 Fe + O2 ____ Fe2O3
Reactantes Productos
Fe 2 2
O 2 3
Con este 2 queda balanceado el Fe, pero que coeficiente le ponemos al O2, si le ponemos un 2 no nos sirve porque serian 4 oxígenos en los reactantes ( el subíndice 2 del oxígeno se multiplica por el coeficiente 2) y en los productos hay tres, pero que sucede si le anotamos un 3
4Fe + 3O2 _____ 2Fe2O3
Reactantes Productos
Fe 4x1 =4 2x2 =4
O 3x2 = 6 2x3 =6
Los coeficientes son 4 para el Fe, 3 para el O2 y 2 para el Fe2O3,
Tarea no. 3
BALANCEA LAS SIGUIENTES ECUACIONES
Sabes que es necesario ser perseverante, no te desanimes si no puedes a la primera vez, inténtalo, cuantas veces sea necesario.
1) Mg + O2 ___ MgO
2) Na + H2O _____ NaOH
3) Mg + N2 ____ Mg3N2
4) MnO2 + Al ____ Al2O3 + Mn
5) H2 O ____ H2 + O2
6) Ca + O2 ___ CaO
7) P4O10 + H2O _____ H3PO4
8) Ca + N2 ____ Ca3N2
9) CdCO3 ____ CdO + CO2
10) C2H6 O + O2 ____ CO2 + H2O
En este tema aprenderás a determinar los coeficientes para balancear una ecuación.
Observa la siguiente ecuación: 2 C4H10(g) + 13 O2(g) --> 8 CO2(g) + 10 H2O(g) + 872 kJ Los números 2, 13, 8 y 10 se llaman coeficientes l¿ De dónde salieron? ¿Para qué sirven?
Balancear significa buscar un “punto de equilibrio” entre dos parte; precisamente el balanceo de ecuaciones consiste en que busques que “coeficientes” debes de anotar para que la “cantidad” de cada uno de los elementos que está en los reactantes se iguale con la de los productos.
El hierro Fe, al contacto con el aire, lentamente se va oxidando, hasta transformarse en un polvo café- rojizo; éste es un ejemplo de reacción química.
Para escribir la ecuación de esta reacción; primero anotas las sustancias que están reaccionado, que son el fierro (Fe) y el oxígeno (O2) , después una flecha que indica la transformación y enseguida los productos. La ecuación queda de la siguiente manera: Fe + O2 ______ Fe2O3
Pero esta ecuación no esta completa, le faltan los “coeficientes”que indican que la ecuación está balanceada. ¿Cómo los vas a encontrar?, ¿Cuáles son esos números?
Para determinar los coeficientes se puede hacer por dos métodos:
A) Por tanteo
B) Por oxido-reducción.
A) Balanceo por tanteo
Pasos:
1.Contar la “cantidad” que hay de cada elemento.
Para esto observa si los elementos tienen subíndice, este número indica la cantidad, si no tienen número significa que es uno. Ejemplo en los reactantes el Fe no tiene subíndice, entonces hay uno , el oxigeno tiene subíndice 2, significa que son dos, en los productos el Fe tiene un subíndice 2, por lo tanto hay dos y el oxígeno tiene un tres, entonces hay 3. Escribes esta información, debajo de la ecuación.
Fe + O2 Fe2O3
Reactantes ProductosFe 1 2
O 2 3
2. La ecuación no esta balanceado porque las cantidades de Fierro y Oxígeno son diferentes en los reactantes y en los productos, el siguiente paso es anotar un coeficiente 2, 3, 4, etc, empieza con el dos, si no da, intenta con el que sigue y así sucesivamente, volver a contar la cantidad de cada elemento en cada intento, hasta que la ecuación quede balanceada.
Veamos que sucede si anotamos como coeficiente un 2 al Fe (Recuerda el lugar donde se escriben los coeficientes) 2 Fe + O2 ____ Fe2O3
Reactantes Productos
Fe 2 2
O 2 3
Con este 2 queda balanceado el Fe, pero que coeficiente le ponemos al O2, si le ponemos un 2 no nos sirve porque serian 4 oxígenos en los reactantes ( el subíndice 2 del oxígeno se multiplica por el coeficiente 2) y en los productos hay tres, pero que sucede si le anotamos un 3
4Fe + 3O2 _____ 2Fe2O3
Reactantes Productos
Fe 4x1 =4 2x2 =4
O 3x2 = 6 2x3 =6
Los coeficientes son 4 para el Fe, 3 para el O2 y 2 para el Fe2O3,
Tarea no. 3
BALANCEA LAS SIGUIENTES ECUACIONES
Sabes que es necesario ser perseverante, no te desanimes si no puedes a la primera vez, inténtalo, cuantas veces sea necesario.
1) Mg + O2 ___ MgO
2) Na + H2O _____ NaOH
3) Mg + N2 ____ Mg3N2
4) MnO2 + Al ____ Al2O3 + Mn
5) H2 O ____ H2 + O2
6) Ca + O2 ___ CaO
7) P4O10 + H2O _____ H3PO4
8) Ca + N2 ____ Ca3N2
9) CdCO3 ____ CdO + CO2
10) C2H6 O + O2 ____ CO2 + H2O
balanceo de ecuaciones por oxido reducción
La oxidación es una reacción química muy poderosa donde un elemento cede electrones, y por lo tanto aumenta su estado de oxidación.3 Se debe tener en cuenta que en realidad una oxidación o una reducción es un proceso por el cual cambia el estado de oxidación de un compuesto. Este cambio no significa necesariamente un intercambio de iones. Suponer esto -que es un error común- implica que todos los compuestos formados mediante un proceso redox son iónicos, puesto que es en éstos compuestos donde sí se da un enlace iónico, producto de la transferencia de electrones.
Por ejemplo, en la reacción de formación del cloruro de hidrógeno a partir de los gases dihidrógeno y dicloro, se da un proceso redox y sin embargo se forma un compuesto covalente.
Estas dos reacciones siempre se dan juntas, es decir, cuando una sustancia se oxida, siempre es por la acción de otra que se reduce. Una cede electrones y la otra los acepta. Por esta razón, se prefiere el término general de reacciones redox.
En una reacción si un elemento se oxida, también debe existir un elemento que se reduce. Recordar que una reacción de oxido reducción no es otra cosa que una perdida y ganancia de electrones, es decir, desprendimiento o absorción de energía (presencia de luz, calor, electricidad, etc.)
Para balancear una reacción por este método , se deben considerar los siguiente pasos
1)Determinar los números de oxidación de los diferentes compuestos que existen en la ecuación.
Para determinar los números de oxidación de una sustancia, se tendrá en cuenta lo siguiente:
En una formula siempre existen en la misma cantidad los números de oxidación positivos y negativos
El Hidrogeno casi siempre trabaja con +1, a ecepcion los hidruros de los hidruros donde trabaja con -1
El Oxigeno casi siempre trabaja con -2
Todo elemento que se encuentre solo, no unido a otro, tiene numero de oxidación 0
2) Una vez determinados los números de oxidación , se analiza elemento por elemento, comparando el primer miembro de la ecuación con el segundo, para ver que elemento químico cambia sus números de oxidación
0 0 +3 -2
Fe + O2 Fe2O3
Los elementos que cambian su numero de oxidación son el Fierro y el Oxigeno, ya que el Oxigeno pasa de 0 a -2 Y el Fierro de 0 a +3
3) se comparan los números de los elementos que variaron, en la escala de Oxido-reducción
0 0 +3 -2
Fe + O2 Fe2O3
El fierro oxida en 3 y el Oxigeno reduce en 2
4) Si el elemento que se oxida o se reduce tiene numero de oxidación 0 , se multiplican los números oxidados o reducidos por el subíndice del elemento que tenga numero de oxidación 0
Fierro se oxida en 3 x 1 = 3
Oxigeno se reduce en 2 x 2 = 4
5) Los números que resultaron se cruzan, es decir el numero del elemento que se oxido se pone al que se reduce y viceversa
4Fe + 3O2 2Fe2O3
Los números obtenidos finalmente se ponen como coeficientes en el miembro de la ecuación que tenga mas términos y de ahí se continua balanceando la ecuación por el método de tanteo
Otros ejemplos
KClO3 KCl + O2
+1 +5 -2 +1 -1 0
KClO3 KCl + O2
Cl reduce en 6 x 1 = 6
O Oxida en 2 x 1 = 2
2KClO3 2KCl + 6O2
Cu + HNO3 NO2 + H2O + Cu(NO3)2
0 +1 +5 -2 +4 -2 +2 -2 +2 +5 -2
Cu + HNO3 NO2 + H2O + Cu(NO3)2
Cu oxida en 2 x 1 = 2
N reduce en 1 x 1 = 1
Cu + HNO3 2NO2 + H2O + Cu(NO3)2
Cu + 4HNO3 2NO2 + 2H2O + Cu(NO3)2
Balanceo de ecuaciones por el método algebraico
Este método esta basado en la aplicación del álgebra. Para balancear ecuaciones se deben considerar los siguientes puntos
1) A cada formula de la ecuación se le asigna una literal y a la flecha de reacción el signo de igual. Ejemplo:
Fe + O2 Fe2O3
A B C
2) Para cada elemento químico de la ecuación, se plantea una ecuación algebraica
Para el Fierro A = 2C
Para el Oxigeno 2B = 3C
3) Este método permite asignarle un valor (el que uno desee) a la letra que aparece en la mayoría de las ecuaciones algebraicas, en este caso la C
Por lo tanto si C = 2
Si resolvemos la primera ecuación algebraica, tendremos:
2B = 3C
2B = 3(2)
B = 6/2
B = 3
Los resultados obtenidos por este método algebraico son
A = 4
B = 3
C = 2
Estos valores los escribimos como coeficientes en las formulas que les corresponden a cada literal de la ecuación química, quedando balanceada la ecuación
4Fe + 3O2 2 Fe2O3
Otros ejemplos
HCl + KmNO4 KCl + MnCl2 + H2O + Cl2
A B C D E F
A = 2E
Cl) A = C + 2D + 2F
B = C
Mn) B = D
O) 4B = E
Si B = 2
4B = E
4(2) = E
E = 8
B = C
C = 2
B = D
D = 2
A = 2E
A = 2 (8)
A = 16
A = C + 2D + 2F
16 = 2 + 2(2) + 2F
F = 10/2
F = 5
16HCl + 2KmNO4 2KCl + 2MnCl2 + 8H2O + 5Cl2
Balanceo de ecuaciones por método algebraico
Este método esta basado en la aplicación del álgebra. Para balancear ecuaciones se deben considerar los siguientes puntos
1) A cada formula de la ecuación se le asigna una literal y a la flecha de reacción el signo de igual. Ejemplo:
Fe + O2 Fe2O3
A B C
2) Para cada elemento químico de la ecuación, se plantea una ecuación algebraica
Para el Fierro A = 2C
Para el Oxigeno 2B = 3C
3) Este método permite asignarle un valor (el que uno desee) a la letra que aparece en la mayoría de las ecuaciones algebraicas, en este caso la C
Por lo tanto si C = 2
Si resolvemos la primera ecuación algebraica, tendremos:
2B = 3C
2B = 3(2)
B = 6/2
B = 3
Los resultados obtenidos por este método algebraico son
A = 4
B = 3
C = 2
Estos valores los escribimos como coeficientes en las formulas que les corresponden a cada literal de la ecuación química, quedando balanceada la ecuación
4Fe + 3O2 2 Fe2O3
Balanceo de ecuaciones por ion electrón
En el semestre anterior de química, usted balanceó ecuaciones químicas sencillas por simple inspección o tanteo. Muchas ecuaciones son demasiado complejas para que este procedimiento de balanceo por tanteo resulte práctico; sin embargo, la gran mayoría de las reacciones de interés en este semestre (electroquímica, equilibrio iónico) son reacciones de óxido-reducción que comprenden la transferencia de electrones de un reactivo a otro, y en estos casos, el balanceo se efectúa aplicando procedimientos sistemáticos. Este último capítulo esta dedicado a los métodos comúnmente usados para el balanceo de estas ecuaciones, a saber el método de la media reacción (o del ión-electrón) y el método del número de oxidación.
Antes de estudiar estos dos métodos de balanceo o igualación de ecuaciones de la media REDOX daremos unas definiciones importantes.
Oxidación: Se refiere a la media reacción donde un átomo o un grupo de átomos pierden e-
Reducción: Se refiere a la media reacción donde un átomo o un grupo de átomos ganan e-
Agente Oxidante: Es la sustancia que se reduce (gana e-) provocando la oxidación.
Ejemplo: NO3- + 2H+ + e- NO2 + H2O (Reducción)
N+5 + e- N+4 (Reducción)
Agente Reductor: Es la sustancia que se oxida (pierde e-) provocando la reducción.
Ejemplo: C + 2H2O C2O + 4H+ + 4e- (Oxidación)
5. Importancia de las reacciones químicas para el hombre, la industria y la naturaleza.
Descripción de los procesos, importancia, ecuaciones químicas y dibujos que
representen dichos procesos.
COMBUSTIÓN
Se ha elaborado la Unidad Didáctica, Estudio de las Reacciones Oxidación-Reducción para ser desarrollada con alumnos y alumnas de 12 a 14 años que cursan el 1er. grado, 1er. ciclo del Nivel Medio, como una alternativa a las problemáticas detectadas como resultados de la investigación realizada en los diferentes libros de Química y prácticas de laboratorio de uso común en nuestras aulas.
La Unidad Didáctica corresponde al último bloque de contenidos que presenta el diseño curricular para el grado, se relaciona con otros bloques como son: Enlace y Estructura Química y Equilibrio Químico y Equilibrio Iónico.
Se atenderán ejes transversales como: Educación para la Salud, Ciencia y Tecnología, Contexto Social y Natural y Democracia y Participación.
Continuamente ocurren en nuestro medio transformaciones, unas de ellas las reacciones de oxidación-reducción constituyen parte importante de nuestras vidas.
¿Cómo sería nuestra vida sin pilas, sin baterías para los automóviles?, ¿y sin energía ?
En nuestro cuerpo, en este instante, están ocurriendo reacciones redox, ejemplo de ellas es la respiración, o más en concreto, la oxigenación de la sangre en los pulmones, la combustión de los nutrientes en las células, etc.
El oxígeno tiene la capacidad de combinarse con diversos elementos para producir óxidos. Por ende, oxidación es la combinación del oxígeno con otra sustancia. Existen oxidaciones que son sumamente lentas, como por ejemplo la del hierro. Cuando la oxidación es rápida se llama combustión.
 |
Pues bien, la combustión se refiere a las reacciones químicas que se establecen entre cualquier compuesto y el oxígeno. A esto también se le llama reacciones de oxidación.
De este tipo de proceso se desprenden energía lumínica y calórica y se llevan a cabo rápidamente.
Cabe destacar que los organismos vivientes, para producir energía, utilizan una combustión controlada de los azúcares. (Ver Combustión a nivel celular).
El material que arde, como el kerosén y el alcohol, es el combustible y el que hacer arder, como el oxígeno, se llama comburente.
Ignición es el valor de temperatura que debe presentar el sistema fisicoquímico para que se pueda dar la combustión de manera natural.
El material que arde, como el kerosén y el alcohol, es el combustible y el que hacer arder, como el oxígeno, se llama comburente.
Ignición es el valor de temperatura que debe presentar el sistema fisicoquímico para que se pueda dar la combustión de manera natural.
El proceso termina cuando se consigue el equilibrio entre la energía de los compuestos que reaccionan y la de los productos de la reacción. Con el punto de ignición se alcanza la temperatura de inflamación, activado por la energía de una chispa o por la llama de un fósforo.
 |
| Triángulo de la combustión. Si uno de los tres factores se elimina, el fuego se extingue. |
Son el carbono y el hidrógeno (hidrocarburos) elementos que entran en combustión más fácilmente. El heptano, propano y el metano -entre otros- son sustancias que se utilizan como combustibles, es decir, como fuentes de calor proporcionados por la combustión.
En síntesis, la combustión se produce cuando convergen los siguientes factores:
-El combustible, es decir, el material que arde (gas, alcohol, carbón, madera, plástico).
-El comburente, el material que hacer arder (oxígeno).
-La temperatura de inflamación, la temperatura más baja a la cual el material inicia la combustión para seguir ardiendo.
En síntesis, la combustión se produce cuando convergen los siguientes factores:
-El combustible, es decir, el material que arde (gas, alcohol, carbón, madera, plástico).
-El comburente, el material que hacer arder (oxígeno).
-La temperatura de inflamación, la temperatura más baja a la cual el material inicia la combustión para seguir ardiendo.
A modo de resumen
Cuando una sustancia se quema (arde) se produce un fenómeno llamadocombustión.
La combustión es un proceso de transformación de la materia que se inicia con un aporte de energía y que, en presencia de oxígeno, da lugar a la formación de nuevas sustancias y a la liberación de energía en forma de calor y luz.
Cuando se quema un papel, el aporte de energía lo proporciona la llama; la reacción ocurre en presencia del aire, el cual contiene oxígeno.
Al producirse la reacción química entre el combustible, en este caso el papel (el que arde) y el comburente, oxígeno (el que hace arder) se obtienen como productos de la reacción química, en general, CO2, H2O ycenizas que corresponden al residuo mineral del papel.
La masa inicial del papel se transformó entonces en cenizas y gases que fueron liberados a la atmósfera. Además, se produce calor y luz.
RESPIRACIÓN
La naturaleza es dinámica. Tanto la materia viva como la inerte sufren continuamente procesos de transformación, de los cuales los más importantes son los que afectan a su constitución. La formación de las rocas, la erosión química de las aguas, el nacimiento de una planta o la respiración de un mamífero son procesos observables que suponen cambios de unas sustancias en otras. Todos ellos, más allá de sus diferencias, tienen algo en común: implican transformaciones a escala molecular, que son las responsables de los cambios materiales observables a simple vista.
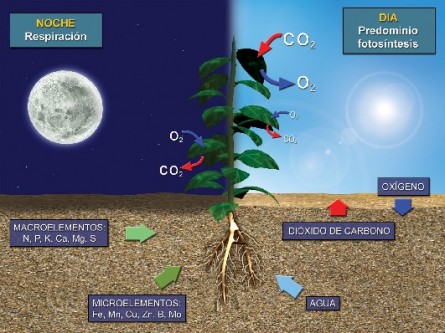
Se estará estudiando acerca de la fotosíntesis y la respiración, tomando en cuenta de que la vida sobre la tierra existe gracias a dos procesos vitales los cuáles son precisamente la fotosíntesis y la respiración.
La fotosíntesis tiene que ver con la forma cómo las plantas transforman la energía solar en energía química liberando al mismo tiempo oxígeno y agua y almacenando la energía bajo la forma de carbohidratos. La respiración se refiere al proceso mediante el cual las plantas toman oxígeno y desprenden dióxido de carbono. Ambos procesos son inversos.
Fotosíntesis y respiración
La fotosíntesis tiene que ver con la forma cómo las plantas transforman la energía solar en energía química liberando al mismo tiempo oxígeno y agua y almacenando la energía bajo la forma de carbohidratos.
La respiración se refiere al proceso mediante el cual las plantas toman oxígeno y desprenden dióxido de carbono. Ambos procesos son inversos.
La vida sobre la tierra existe gracias a dos procesos vitales: La fotosíntesis y la respiración.
LA FOTOSÍNTESIS
En la fotosíntesis las células con clorofila de las plantas verdes atrapan una pequeña cantidad de energía luminosa para convertir el dióxido de carbono que toman del aire y el agua que toman del suelo en azúcar y oxígeno que es energía química. Se estudian juntas porque son dos funciones metabólicas antagónicas, pero complementarias ya que depende la una de la otra.
Se ha avanzado mucho, sobre todo en los últimos años, en cuanto a los procesos de la fotosíntesis, aunque todavía hay aspectos que no se conocen suficientemente. El proceso se puede empezar a partir de la siguiente reacción química:
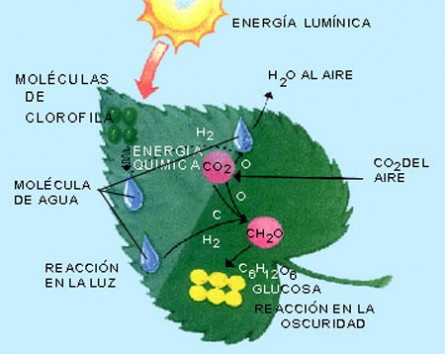
Este proceso se realiza en un organoide llamado cloroplasto que es único y exclusivo de las células vegetales y tienen en su interior la clorofila. Se considera que se produce en dos fases sucesivas: Una, en presencia de luz o reacción fotoquímica y la otra se da en la fase oscura o afotónica.
¿Qué ocurre en la fase luminosa?
Es la primera fase del proceso fotosintético y ocurre en las membranas tilacoidales de los cloroplastos y en presencia de luz, poseen dos sistemas: unsistema de pigmentos que captan la luz y un sistema o cadena de transporte de electrones. En esta fase la clorofila capta la luz, "se excita" y trae como consecuencia tres sucesos:
1. Fotólisis del agua ()
2. Síntesis de nicotinamida - adenin - dinucleótido fosfato (NADPH)
3.Síntesis de adenosin - trifosfato (ATP)
La fotolisis del agua ocurre por descomposición de la molécula de agua en sus elementos constituyentes (H y O) por acción de la luz.
El oxígeno es liberado (O2) a la atmósfera a través de los estomas de las hojas. La síntesis del (NADPH) se forma a partir del NADP+ el cual acepta electrones. La síntesis de adenosin - trifosfato (ATP) se forma a partir del adenosin - difosfato (ADP) y el fosfato inorgánico (Pi)
¿Que ocurre en la etapa oscura?
En esta etapa se realiza la síntesis de la glucosa mediante la participación del NADPH y el ATP producidos en la etapa luminosa además del Dióxido de Carbono () que es tomado de la atmósfera, en esta etapa no se requiere de luz para realizar sus funciones.
La síntesis de la glucosa ocurre en el estroma de los cloroplastos e implica una serie de reacciones químicas que forman el llamado Ciclo de Calvin las fases más importantes de este ciclo son: Fijación del dióxido de carbono. Síntesis de azúcares. Regeneración de la ribulosa - 1,5 - difosfato.
La respiración
La mayoría de los seres vivos realizan esta función, mediante la cual toman el oxígeno de la atmósfera y expulsan el dióxido de carbono, además del agua dicho, en otros términos en la transformación de la molécula de azúcar y oxigeno, producto de la fotosíntesis en dióxido de carbono, agua y ATP. Losanimales poseen estructuras respiratorias como pulmones, bronquios, traqueas o piel según sea la especie del animal, mientras que las plantas respiran a través de los estomas de las hojas.
Cualquiera que sea la manera de como se incorpora el oxígeno al organismo, el destino es llegar a la célula donde se produce la respiración celular y en organoide especifico llamado Mitocondria que se encuentra en la célula ya sea animal o vegetal. El proceso de respiración no es igual para todas las células ya que existen dos tipos de respiración, según sean los requerimientos de oxígeno por parte de la célula; respiración aeróbica y anaeróbica.
¿Qué es la respiración aeróbica?
Es un conjunto de reacciones químicas que ocurren intracelularmente y consiste en la degradación de la glucosa hasta que se convierte en  agua y energía en forma de ATP en presencia de oxigeno. La respiración comprende tres procesos: La glucólisis, el Ciclo de Krebs y la cadena de transporte de electrones. El objetivo final de la respiración celular es producir la energía que la célula necesita para realizar trabajo mecánico, químico y de transporte.
agua y energía en forma de ATP en presencia de oxigeno. La respiración comprende tres procesos: La glucólisis, el Ciclo de Krebs y la cadena de transporte de electrones. El objetivo final de la respiración celular es producir la energía que la célula necesita para realizar trabajo mecánico, químico y de transporte.
 agua y energía en forma de ATP en presencia de oxigeno. La respiración comprende tres procesos: La glucólisis, el Ciclo de Krebs y la cadena de transporte de electrones. El objetivo final de la respiración celular es producir la energía que la célula necesita para realizar trabajo mecánico, químico y de transporte.
agua y energía en forma de ATP en presencia de oxigeno. La respiración comprende tres procesos: La glucólisis, el Ciclo de Krebs y la cadena de transporte de electrones. El objetivo final de la respiración celular es producir la energía que la célula necesita para realizar trabajo mecánico, químico y de transporte.¿Qué ocurre en la respiración anaeróbica?
Este tipo de respiración se caracteriza por una serie de reacciones en las que se obtienen energía (ATP) a partir de compuestos orgánicos. El proceso fundamentalmente consiste en realizar la oxidación del alimento o materia orgánica. Los productos finales de la respiración anaeróbica no son tan simples, ya que se obtienen productos que almacenan bastante energía y dióxido de carbono. Esta respiración es propia de organismos poco evolucionados y son de gran utilidad ya que esto permite explicar los fenómenos de fermentación y putrefacción de ciertos alimentos.
Se puede decir que la fermentación consiste en el catabolismo anaeróbico de los nutrientes orgánicos para producir ATP, además de alcohol etílico, ácido láctico, acetato, ácido butírico y otros. Hay dos tipos de fermentación importantes:
- la fermentación homoláctica que puede ocurrir en los músculos y producir ácido láctico. Esta se da en ausencia de oxígeno y es propia de los organismos inferiores y poco evolucionados como las bacterias y los hongos microscópicos conocidos como levaduras.
Fotosíntesis
Proceso en virtud del cual los organismos con clorofila, como las plantas verdes, las algas y algunas bacterias, capturan energía en forma de luz y la transforman en energía química.
Prácticamente toda la energía que consume la vida de la biosfera terrestre la zona del planeta en la cual hay vida procede de la fotosíntesis.
Una ecuación generalizada y no equilibrada de la fotosíntesis en presencia de luz sería: CO2 + 2H2A ? (CH2) + H2O + H2A El elemento H2A de la fórmula representa un compuesto oxidable, es decir, un compuesto del cual se pueden extraer electrones; CO2 es el dióxido de carbono; CH2 una generalización de los hidratos de carbono que incorpora el organismo vivo. En la gran mayoría de los organismos fotosintéticos, es decir, en las algas y las plantas verdes, H2A es agua (H2O); pero en algunas bacterias fotosintéticas, H2A es anhídrido sulfúrico (H2S). La fotosíntesis con agua es la más importante y conocida y, por tanto, será la que tratemos con detalle.
La fotosíntesis se realiza en dos etapas: una serie de reacciones que dependen de la luz y son independientes de la temperatura, y otra serie que dependen de la temperatura y son independientes de la luz. La velocidad de la primera etapa, llamada reacción lumínica, aumenta con la intensidad luminosa (dentro de ciertos límites), pero no con la temperatura. En la segunda etapa, llamada reacción en la oscuridad, la velocidad aumenta con la temperatura (dentro de ciertos límites), pero no con la intensidad luminosa.
Fase luminosa en el proceso de la fotosíntesis
Los experimentos de Blackman se incluía que en la fotosíntesis actúan dos procesos: uno oscuro (dependientes de la concentración de CO2) y otro luminoso. Mientras que la velocidad del primero es fuertemente afectada por la temperatura, la velocidad del proceso luminoso es poco afectada por ella. Experimentos posteriores han confirmado la utilidad de la separación conceptual de ambos procesos, oscuro y luminoso.
En el primer proceso, las llamadas "reacciones luminosas", los protones derivados del agua se utilizan en la síntesis quimiostática de ATP a partir de ADP y Pi, en tanto un átomo de hidrógeno del agua se utiliza para la reducción de NADP+ a NADPH. Las reacciones se caracterizan por la producción, dependiente del a luz, de oxigeno gaseoso que deriva de la ruptura de las moléculas de agua. Estas reacciones son posibles debido a que los organismos fotosintéticos pueden recolectar la energía luminosa mediante varios procesos y la utilizan para conducir reacciones metabólicas.
REACCIONES DEPENDIENTES DE LA LUZ
Las reacciones dependientes de la luz requieren luz; convierten la energía lumínica en energía química, que se captura en el ATP y el NADPH (una molécula que transporta electrones y átomos de hidrógeno). Solo la energía química puede hacer trabajo biológico.
La energía lumínica se transforma en energía química cuando mueve electrones más lejos de sus núcleos atómicos: Recuérdese que cuando más lejos esta un electrón del núcleo más energía química retiene.
La energía adicional retenida por el electrón desplazado se libera cuando el electrón se mueve más cerca del núcleo del otro átomo: La energía liberada es capturada y utilizada para formar las moléculas transportadoras especiales, ATP o NADPH, las cuales luego son usadas en las reacciones independientes de la luz.
Las reacciones de fotosíntesis dependientes de la luz tienen lugar en membranas, donde enzimas y otras moléculas que promueven las reacciones son embebidas. En los cloroplastos de las plantas y las algas, estas membranas son bolsas aplanadas, llamadas tilacoides, que se organizan en pilas llamadas granas
La fotosíntesis tiene que ver con la forma cómo las plantas transforman la energía solar en energía química liberando al mismo tiempo oxígeno y agua y almacenando la energía bajo la forma de carbohidratos. La respiración se refiere al proceso mediante el cual las plantas toman oxígeno y desprenden dióxido de carbono. Ambos procesos son inversos.
Reacción en la oscuridad
La reacción en la oscuridad tiene lugar en el estroma o matriz de los cloroplastos, donde la energía almacenada en forma de ATP y NADPH2 se usa para reducir el dióxido de carbono a carbono orgánico. Esta función se lleva a cabo mediante una serie de reacciones llamada ciclo de Calvin, activadas por la energía de ATP y NADPH2. Cada vez que se recorre el ciclo entra una molécula de dióxido de carbono, que inicialmente se combina con un azúcar de cinco carbonos llamado ribulosa 1,5-difosfato para formar dos moléculas de un compuesto de tres carbonos llamado 3-fosfoglicerato. Tres recorridos del ciclo, en cada uno de los cuales se consume una molécula de dióxido de carbono, dos de NADPH2 y tres de ATP, rinden una molécula con tres carbonos llamada gliceraldehído 3-fosfato; dos de estas moléculas se combinan para formar el azúcar de seis carbonos glucosa. En cada recorrido del ciclo, se regenera la ribulosa 1,5-difosfato.
Por tanto, el efecto neto de la fotosíntesis es la captura temporal de energía luminosa en los enlaces químicos de ATP y NADPH2 por medio de la reacción en presencia de luz, y la captura permanente de esa energía en forma de glucosa mediante la reacción en la oscuridad. En el curso de la reacción en presencia de luz se escinde la molécula de agua para obtener los electrones que transfieren la energía luminosa con la que se forman ATP y NADPH2. El dióxido de carbono se reduce en el curso de la reacción en la oscuridad para convertirse en base de la molécula de azúcar.
FOTOSÍNTESIS
Es la función por la cual las plantas verdes mediante la clorofila y en presencia de la luz solar, transforma el dióxido de carbono y el agua en sustancias hidrocarbonadas con desprendimiento de oxigeno.
Esta ruta metabólica concluye con las síntesis de carbohidratos, a partir de dióxido de carbono y agua mediante el uso dela energía radiante de la luz solar.
El proceso de la fotosíntesis ocurre en las células de organismos autógrafos, como las plantas superiores y las algas, en organelos especializados llamados cloroplastos. También se realiza en algunas bacterias en el ámbito de la membrana plasmática.
La ecuación general que describe el proceso de la fotosíntesis es la siguiente:
Luz
6CO2 + 6H2O + 18ATP C6H12O6 + 6O2 + 18ADP + 18 Pi
En otras palabras la fotosíntesis consiste en acumular energía luminosa en forma de energía química que luego es utilizada por los animales en la realización de sus diversas actividades.
DEFINICIÓN DE LA FOTOSÍNTESIS
Es un proceso por el cual los vegetales (verdes) toman la energía del sol y la transforman en energía por la que se alimentan. Por ese proceso el dióxido de carbono (CO2) y el agua se transforman en moléculas orgánicas más complejas (como la glucosa) que permiten asimilar el carbono. Simultáneamente se libera oxigeno y se almacena energía para ser utilizada en los procesos metabólicos del vegetal.

CARACTERISTICAS QUIMICAS
La energía de la luz solar es transformada en energía química cuando se combinan el bióxido de carbono y el agua para la formación de glucosa. Una vez que se ha formado la glucosa, esta es una fuente de energía potencial.
La energía luminosa es convertida en la energía química de la glucosa.
La síntesis de la glucosa se lleva a cabo en una serie de pasos regulados por enzimas. Parte de la energía química es almacenada en la glucosa.

LLUVIA ÁCIDA
La lluvia ácida se forma cuando la humedad en el aire se combina con los óxidos de nitrógeno, el dióxido de azufre y el trióxido de azufre emitidos por fábricas, centrales eléctricas, calderas de calefacción y vehículos que queman carbón o productos derivados del petróleo que contengan azufre. En interacción con el agua de la lluvia, estos gases forman ácidos nítricos, ácido sulfuroso y ácido sulfúrico. Finalmente, estas sustancias químicas caen a la tierra acompañando a las precipitaciones, constituyendo la lluvia ácida.
Los contaminantes atmosféricos primarios que dan origen a la lluvia ácida pueden recorrer grandes distancias, siendo trasladados por los vientos cientos o miles de kilómetros antes de precipitar en forma de rocío, lluvia, llovizna, granizo, nieve, niebla o neblina. Cuando la precipitación se produce, puede provocar importantes deterioros en el ambiente.
La lluvia ácida puede ser causada por muchos químicos, el azufre (S), el cloro (Cl) y potencialmente hasta ppor el dióxido de carbono (CO2), por ejemplo, el CO2 en contacto con el agua puede formar el ácido carbónico, que es un ácido débil, pero ácido al fin:
CO2 + H2O <-------> H2CO3
El azufre, que en general en la atmosfera se encuentra como dióxido de azufre (SO2), también reacciona con el agua:
SO2 + 1/2 O2 <-------> SO3
SO3 + H2O <-------> H2SO4
y el HCl es un gas, y en general se encuentra así en la atmosfera, o diluido en agua.
La lluvia ácida se produce cuando estos gases son oxidados en la atmósfera y reaccionan con el agua de lluvia formando los ácidos respectivos. El SO2 genera los ácido sulfuroso (H2SO3) y sulfúrico (H2SO4), de la misma forma los ácidos nitroso (HNO2) y nítrico (HNO3):
SO2+H2O ----H2SO3
SO2+O SO3 + H2O ----H2SO4
2NO2 +H2O ----HNO2 + HNO3
La lluvia ácida es una de las consecuencias de la contaminación del aire. Cuando cualquier tipo de combustible se quema, diferentes productos químicos se liberan al aire. El humo de las fábricas, el que proviene de un incendio o el que genera un automóvil, no sólo contiene partículas de color gris (fácilmente visibles), sino que además poseen una gran cantidad de gases invisibles altamente perjudiciales para nuestro medio ambiente.
Centrales eléctricas, fábricas, maquinarias y coches "queman” combustibles, por lo tanto, todos son productores de gases contaminantes. Algunos de estos gases (en especial los óxidos de nitrógeno y el dióxido de azufre) reaccionan al contacto con la humedad del aire y se transforman en ácido sulfúrico, ácido nítrico y ácido clorhídrico. Estos ácidos se depositan en las nubes. La lluvia que producen estas nubes, que contienen pequeñas partículas de acido, se conoce con el nombre de "lluvia ácida".
El humo y los gases provenientes de automotores y fábricas forman ácidos al mezclarse con el aire. Si el humo contiene dióxido de azufre, al mezclarse con el vapor de agua, la lluvia contendrá ácido sulfúrico. Si el humo contiene óxido de nitrógeno, en el agua de lluvia habrá ácido nítrico.
Los componentes tóxicos que forman la lluvia acida son el dióxido de azufre y el oxido de nitrógeno provenientes de la combustión del carbón o de hidrocarburos. Mediante una serie de reacciones químicas, el dióxido de azufre se transforma en trióxido de azufre que a su vez y a través de algunos catalizadores ambientales o bien por la acción directa de la luz solar, se transforma en acido sulfúrico provocando importantes daños ambientales al regresar a la tierra a través de la lluvia acida.
La lluvia ácida puede ser causada por muchos químicos, el azufre (S), el cloro (Cl) y potencialmente hasta ppor el dióxido de carbono (CO2), por ejemplo, el CO2 en contacto con el agua puede formar el ácido carbónico, que es un ácido débil, pero ácido al fin:
CO2 + H2O <-------> H2CO3
El azufre, que en general en la atmosfera se encuentra como dióxido de azufre (SO2), también reacciona con el agua:
SO2 + 1/2 O2 <-------> SO3
SO3 + H2O <-------> H2SO4
y el HCl es un gas, y en general se encuentra así en la atmosfera, o diluido en agua.
La lluvia ácida se produce cuando estos gases son oxidados en la atmósfera y reaccionan con el agua de lluvia formando los ácidos respectivos. El SO2 genera los ácido sulfuroso (H2SO3) y sulfúrico (H2SO4), de la misma forma los ácidos nitroso (HNO2) y nítrico (HNO3):
SO2+H2O ----H2SO3
SO2+O SO3 + H2O ----H2SO4
2NO2 +H2O ----HNO2 + HNO3
La lluvia ácida es una de las consecuencias de la contaminación del aire. Cuando cualquier tipo de combustible se quema, diferentes productos químicos se liberan al aire. El humo de las fábricas, el que proviene de un incendio o el que genera un automóvil, no sólo contiene partículas de color gris (fácilmente visibles), sino que además poseen una gran cantidad de gases invisibles altamente perjudiciales para nuestro medio ambiente.
Centrales eléctricas, fábricas, maquinarias y coches "queman” combustibles, por lo tanto, todos son productores de gases contaminantes. Algunos de estos gases (en especial los óxidos de nitrógeno y el dióxido de azufre) reaccionan al contacto con la humedad del aire y se transforman en ácido sulfúrico, ácido nítrico y ácido clorhídrico. Estos ácidos se depositan en las nubes. La lluvia que producen estas nubes, que contienen pequeñas partículas de acido, se conoce con el nombre de "lluvia ácida".
El humo y los gases provenientes de automotores y fábricas forman ácidos al mezclarse con el aire. Si el humo contiene dióxido de azufre, al mezclarse con el vapor de agua, la lluvia contendrá ácido sulfúrico. Si el humo contiene óxido de nitrógeno, en el agua de lluvia habrá ácido nítrico.
Los componentes tóxicos que forman la lluvia acida son el dióxido de azufre y el oxido de nitrógeno provenientes de la combustión del carbón o de hidrocarburos. Mediante una serie de reacciones químicas, el dióxido de azufre se transforma en trióxido de azufre que a su vez y a través de algunos catalizadores ambientales o bien por la acción directa de la luz solar, se transforma en acido sulfúrico provocando importantes daños ambientales al regresar a la tierra a través de la lluvia acida.
DIGESTIÓN
La digestión es el proceso de transformación de los alimentos, previamente ingeridos, en sustancias más sencillas para ser absorbidos. La digestión ocurre tanto en los organismos pluricelulares como en las células, (ver digestión intracelular). En este proceso participan diferentes tipos de enzimas.
El sistema o aparato digestivo,1 es muy importante en la digestión ya que los organismos heteroscios dependen de fuentes externas de materias primas y energía para crecimiento, mantenimiento y funcionamiento. El alimento se emplea para generar y reparar tejidos y obtención de energía. Los organismos autótrofos (las plantas, organismos fotosintéticos), por el contrario, captan la energía lumínica y la transforman en energía química, utilizable por los animales.
Al morder un pedazo de pan y masticarlo, la acción mecánica de tus dientes lo rompe, pero no puedes absorber los nutrientes si la digestión se detiene allí. Si continúas mascando, algo sorprendente sucede. Tu bocado se convierte en dulce. Las sustancias químicas digestivas en la saliva denominadas enzimas descomponen los carbohidratos complejos como el pan en hidratos de carbono simples o azúcares. Más tarde, en el estómago y en los intestinos, las proteínas y las grasas también se descomponen químicamente. Sin enzimas, la digestión no se pudiera completar y pudieras morir de desnutrición, incluso si comieras y masticaras todo el día.
Al morder un pedazo de pan y masticarlo, la acción mecánica de tus dientes lo rompe, pero no puedes absorber los nutrientes si la digestión se detiene allí. Si continúas mascando, algo sorprendente sucede. Tu bocado se convierte en dulce. Las sustancias químicas digestivas en la saliva denominadas enzimas descomponen los carbohidratos complejos como el pan en hidratos de carbono simples o azúcares. Más tarde, en el estómago y en los intestinos, las proteínas y las grasas también se descomponen químicamente. Sin enzimas, la digestión no se pudiera completar y pudieras morir de desnutrición, incluso si comieras y masticaras todo el día.
OXIDACIÓN DE LOS METALES
La oxidación es una reacción química donde un metal o un no metal cede electrones, y por tanto aumenta su estado de oxidación. La reacción química opuesta a la oxidación se conoce como reducción, es decir cuando una especie química acepta electrones. Estas dos reacciones siempre se dan juntas, es decir, cuando una sustancia se oxida, siempre es por la acción de otra que se reduce. Una cede electrones y la otra los acepta. Por esta razón, se prefiere el término general de reacciones redox. La propia vida es un fenómeno redox. El oxígeno es el mejor oxidante que existe debido a que la molécula es poco reactiva (por su doble enlace) y sin embargo es muy electronegativo, casi como el flúor.

La corrosión es definida como el deterioro de un material a consecuencia de un ataque electroquímico por su entorno, la velocidad a la que tiene lugar dependerá en alguna medida de la temperatura, la salinidad del medio y las propiedades de los materiales en cuestión, entre ellos puede mencionarse los procesos de desgaste por fricción, por erosión o por diversos otros factores mecánicos.
Una característica importante de los procesos de corrosión es que los eventos ocurren espontáneamente en la naturaleza, en términos termodinámicos, esto equivale a decir que la variación de energía libre (∆G0) de la reacción global es menor que cero.
La corrosión ordinaria, es un proceso redox por el cual los metales se oxidan por medio del oxígeno O2 , en presencia de humedad. El oxígeno en estado gaseoso es un agente oxidante, y la mayoría de los metales tienen potenciales de reducción menores que éste, por lo tanto son fácilmente oxidables.
Se sabe que la oxidación de los metales tiene lugar más fácilmente en puntos donde la tensión es mayor (donde los metales son más “activos”). Así, un clavo de acero, que en su mayor parte es hierro, se corroe primero en la punta y en la cabeza. Un clavo doblado se corroe más fácilmente en el recodo.

Un punto de tensión en un objeto de acero actúa como ánodo donde el hierro se oxida a iones Fe2+ y se forman hendiduras. Los electrones producidos fluyen a través del clavo hacia las áreas expuestas al O2. Estas actúan como cátodos donde el O2(g) se reduce a iones hidróxido, (OH)-:
O2(g) + H2O(l) + 4 e- ↔ 4(OH)-(aq)
Al mismo tiempo, los iones Fe2+ migran a través de la superficie húmeda. La reacción global se obtiene ajustando la transferencia electrónica y sumando las dos semirreacciones:
2(Fe(s) → Fe2+(aq) + 2e- ) (oxidación, ánodo)
O2(g) + H2O(l) + 4 e- → 4(OH)-(aq) (reducción, cátodo)
________________________________________
2Fe(s) + O2(g) + 2H2O(l) → 2Fe2+(aq) + 4(OH)-(aq) (reacción global)
Los iones Fe2+ pueden migrar desde el ánodo a través de la disolución hacia la región catódica, donde se combinan con los iones (OH)- para formar óxido de hierro (II). El hierro de oxida aún más por el O2(g) hasta el estado de oxidación 3+, formándose el óxido de hierro (III) o también llamado herrumbre Fe2O3(s) , de color rojo.
4 Fe2+(aq) + O2(g) + 4 H2O(l) → 2 Fe2O3(s) + 8 H+(aq)
Algunos de los procesos más familiares de corrosión son la herrumbre del hierro y el acero y la formación de pátina verde en el cobre y sus aleaciones bronce y latón.
No siempre que se presenta la oxidación de un metal existe corrosión, en algunos casos el óxido formado es resistente y forma una capa gruesa de óxido que impide que el resto del material continúe oxidándose. Esto fenómeno es común en materiales de aluminio, zinc y magnesio.
Sin embargo, la corrosión es un fenómeno mucho más amplio que afecta aún materiales no metálicos (cerámicas, polímeros, etc.), que sufren corrosión mediante otros mecanismos dependiendo del medio ambiente.
https://www.youtube.com/watch?v=G5a7FLH5l2I&noredirect=1
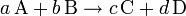



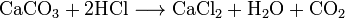
Hola, me llamo Marco y quiero decirte que estás bn lokis amija
ResponderBorrarMUY BUEN TRABAJO PARA TU EDAD. VAS HA SER QUÍMICA LO ASEGURO SALUDOS
ResponderBorrarEntonces no hay ecuacion quimica para la digestion?
ResponderBorrartienes buenos articulos aqui! Si alguien aquí está buscando un préstamo a tasa 2 a cambio de comprar una casa u otras necesidades de financiamiento, quiero que se comunique con el Sr. Pedro en pedroloanss@gmail.com cuando me presentaron al Sr. pedro en el seminario de vigilancia del mercado, estaba ingresando al mercado como comprador por primera vez. naturalmente, mis necesidades eran un poco diferentes y tenía muchas preguntas. antes de enviarme mi carta de aprobación previa, llamó para hablar conmigo sobre lo que significaba y lo que podría cambiar. se puso a mi disposición prácticamente a cualquier hora por correo electrónico y mensajes de texto. fue muy receptivo y conocedor. también es muy sencillo. Le expliqué cuáles eran mis expectativas en cuanto a la hora de cierre y otros detalles. dijo que cumpliría con esas expectativas pero las superó. Cerré tan rápido que mi agente de bienes raíces y el vendedor, por supuesto, estaban entusiasmados con eso. pero como comprador, aprecié que me guiaran a través del proceso de oferta de préstamo del Sr. Pedro. desde la aprobación previa hasta el cierre, el viaje fue muy fluido y me considero afortunado porque he escuchado historias de terror. Lo recomiendo a cualquiera que busque un préstamo. todo se manejó electrónicamente de manera conveniente y segura
ResponderBorrar